广西教师招聘考试交流群:425524292 志公·好老师微信号
【氧化还原反应】
1.氧化还原反应五规律
(1)表现性质的规律:同种元素具有多种价态时,一般处于最低价时只具有还原性,处于最高价时只具有氧化性,处于中间可变价时既具有氧化性又具有还原性。
(2)性质强弱的规律
(3)反应先后的一般规律:在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧剂,则它首先与溶液中还原性最强的还原剂作用;同理,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中氧化性最强的氧化剂作用。
(4)价态归中的规律:含同种元素不同价态的物质间发生氧化—还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。这里的中间价可以相同(谓之“靠拢”),也可以不同,但此时必是高价转变成较高中间价,低价转变成较低中间价(谓之“不相错”)。
(5)在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
2.氧化性还原性强弱比较
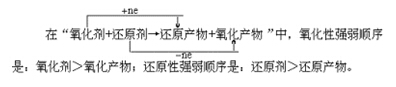
(1)根据化学方程式判断:一般的氧化还原反应可写成通式:氧化剂+还原剂=还原产物+氧化产物。
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)根据元素的化合价判断:一般的说,氧化剂含有较高价态的元素,还原剂含有较低价态的元素。变价元素处于最高价态时只有氧化性;处于最低价态时只有还原性;处于中间价态时,既有氧化性又有还原性。可记忆为:“高价氧化低价还,中间价态两边转”。
(3)根据金属的活动性顺序表判断:
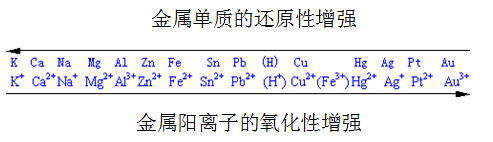
其一般的反应规律是:“上左下右可反应,隔之愈远愈易行”。
(4)根据变价元素被氧化或被还原得程度判断:如:2Fe+3Cl2=2FeCl3;Fe+S=FeS。根据变价金属元素Fe被氧化的程度:被Cl2氧化成+3价,而S只能把其氧化成+2价,判断氧化性:Cl2>S。
(5)根据氧化还原反应进行的难易程度(反应条件)来判断:如:①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;②MnO2+4HCl(浓)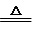 MnCl2+Cl2↑+2H2O;前者比后者容易,可判断氧化性:KMnO4 >MnO2 。
MnCl2+Cl2↑+2H2O;前者比后者容易,可判断氧化性:KMnO4 >MnO2 。
上一篇:第一页